-
日期: 2025-01-27 | 来源: 知识分子 | 有1人参与评论 | 字体: 小 中 大
直到2015年11月出台的文件要求,国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂,应在2018年底前完成一致性评价。首批需要一致性评价的国家基药目录涉及289个品种,1.7万个批准文号,1800多家企业。对于仿制药企业来说,想留在目录里,先过评。
“补课”开始的第三年,2018年,第一批集中带量采购在11座城市铺开,确保采购数量的通用名药品招采,成为中国仿制药替代的历史元年。
九年来,通过一致性评价的仿制药覆盖了1300多个品种。但考虑到中国化学药品有6000余种,也就说,中国药品市场上流通的大部分药物都没有通过一致性评价,其疗效如何,恐怕要打个问号。
02
一致性评价会造假吗?
仿制药不等于集采药,但是想要进入集采名单,必须是通过了一致性评价的仿制药。
为了证明仿制药能在人体内起到和原研药类似的效果,应进行三个层次的评价:体外药学一致(多条溶出曲线与原研药的溶出曲线一致),体内生物利用度一致(即生物等效性试验,一个仿制药其生物利用度应达到原研药的80%-125%),还有临床疗效一致(即获得医生、患者广泛认可)。
中国参考了美国和日本(专题)的评价方式,把药品按照生物药剂学分类系统(BCS)进行分类,满足一定要求的制剂以体内生物等效实验替代临床对比试验。一些制剂可以用体外溶出度的一致性结果申请生物等效性试验的豁免资格(注:为了节约成本和提高工作效率,降低患者负担,一些高溶解性、高渗透性特点的药物,其口服常释制剂的生物不等效风险通常较低,通常被认为可以豁免人体生物等效性试验)。
在国家药品审评中心有20年工作经验的张星一说,“当时药审中心是按照全球最严格标准设计的方案,翻译了日本药监局PMDA发布的上百种药物的4种条件下的溶出曲线,把它们挂在中心网站上让大家学习。生物等效性试验对于餐前餐后的要求也是非常严格的。从技术审评要求来看,中国的标准已经是全球最严,否则难以服众。”
然而近期多起讨论指向一个问题,一致性评价是不是无懈可击,毫无漏洞可钻?
1月24日,有人注意到,国家药品监督管理局药审中心通过一致性评价的几例仿制药存在数据雷同。当天下午,药监局回应,是在公开相关信息时,编辑错误导致雷同。
然而,有网友指出,即使在当日下午修正后的版本中,在Lek Pharmaceutical瑞舒伐他汀钙片生物等效性研究结果的餐后BE血药浓度(AUC)指标中,测试样本T值与对照品R值同为74.3,却得出了T/R比值为98.95%,而非100%。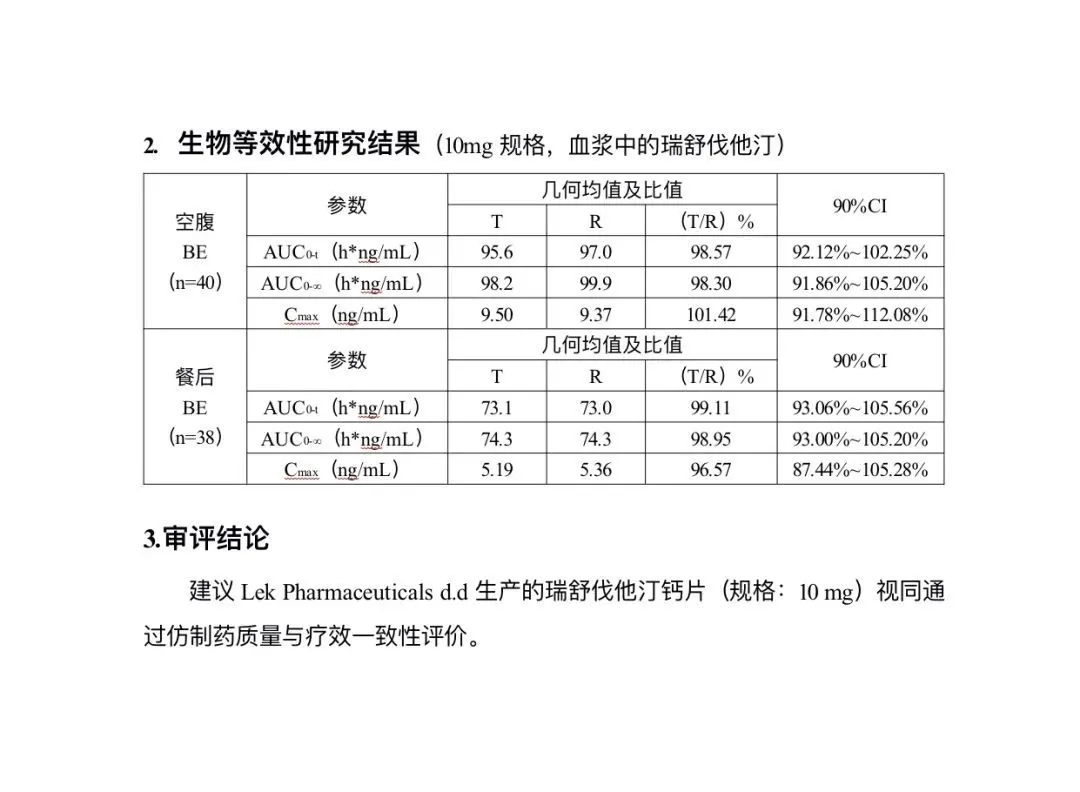
业内人士认为,药监局和相关企业可能需要公布更完整的原始数据才能做出更有可信度和说服力的澄清。但此后,药监局药审中心网站中仿制药一致性评价的信息无法下载。
在药监局当天尚未发布声明之前,多位业内人士对于“数据雷同”的猜测,第一反应是看出现雷同的数据是不是来自同一家CRO(合同研究组织)公司。在一致性评价过程中,许多仿制药生产企业会委托CRO进行生物等效性试验等工作。
2015年7月,中国药监部门重拳出击,主要针对药品临床试验数据造假行为,开展大规模的药品核查行动。核查结果显示,不予批准和企业主动撤回的占89%。其中绝大部分是仿制药的申请。
这场被业内称为“722风暴”的行动之后,我们的临床试验数据审批和核查一度趋严。
但也有人指出,不排除CRO为了拿到和交付项目,可能通过数据造假来达成甲方的要求,“因为“生物等效性太难做了,尤其在一致性评价要求出台的最初阶段,临床试验机构少,技术尚不成熟,虽然文件规定生物等效性实验样本量只需18-24人,但由于通过率低,往往需要做到几十例,一些高变异的产品像氯吡格雷做到上百例花费上千万也常常出现, ”前述仿制药行业从业者介绍。- 新闻来源于其它媒体,内容不代表本站立场!
-
原文链接
原文链接: